
À quand remonte l’utilisation de la stimulation magnétique transcrânienne (TMS) ?
Le principe d’induction électromagnétique à la base du fonctionnement de la TMS a été découvert en 1831 par le physicien anglais Michael Faraday (Faraday, 1839). Ce principe stipule qu’un champ magnétique changeant rapidement d’orientation produit un courant électrique dans un élément conducteur à proximité (Irving et Chang, 2015). Dans le cas de la TMS, un champ magnétique est généré par un courant qui circule à travers une bobine de plastique positionnée sur le cuir chevelu (voir figure 1). Le champ magnétique induit, à son tour, un courant secondaire dans une petite aire du cerveau située sous la bobine, permettant ainsi d’agir sur l’activité des neurones (pour plus d’information sur le fonctionnement de la TMS, nous vous invitons à lire notre billet de blogue « TMS pour mieux comprendre »).
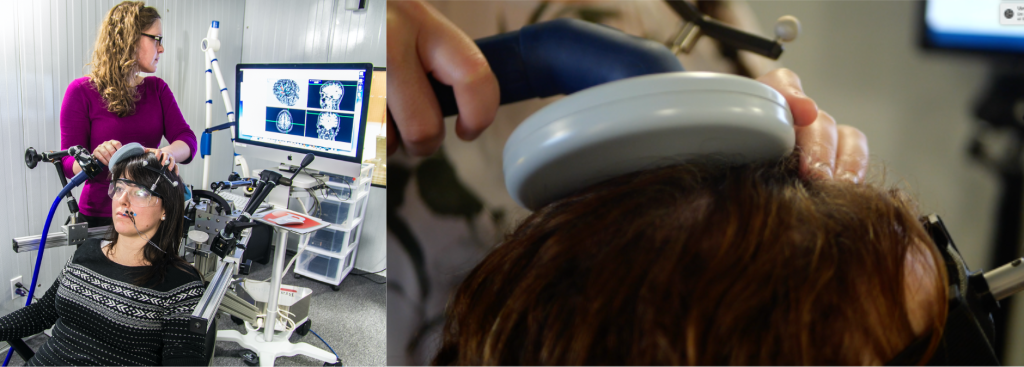
Figure 1. Illustration d’une séance de TMS, dans laquelle on peut voir la bobine positionnée sur la tête de la participante.
En 1896, Jacques-Arsène d’Arsonval, un physicien français, a peut-être été le premier à documenter une technique s’apparentant à la TMS moderne (Georges et coll., 2007). D’Arsonval a observé que lorsque des individus positionnaient leur tête dans une bobine émettant un champ magnétique, ceux-ci rapportaient des phosphènes (c.-à-d. la sensation de voir une lumière ou de percevoir des taches dans le champ visuel), phénomène aujourd’hui associé à une activité induite par la TMS dans la rétine ou le cortex visuel, par exemple lorsque la stimulation est appliquée au cortex visuel, c’est-à-dire la partie du cerveau qui reçoit les informations visuelles (Webster et Ro, 2017). D’Arsonval a aussi induit des vertiges et des syncopes avec sa méthode (Geddes, 1999).
À la suite des travaux d’Arsonval, en 1902, en Autriche, les psychiatres Adrian Pollacsek et Berthold Beer ont rapporté avoir utilisé une bobine électromagnétique, positionnée au-dessus de la tête pour traiter la dépression et les névroses. Cette expérience serait l’une des premières tentatives d’utilisation d’une technique s’apparentant à la TMS à des fins cliniques (Georges et coll., 2007).
Quelques décennies plus tard, en 1959, Alexander Kolin et ses collègues, travaillant au département de biophysique à l’Université de Californie aux États-Unis, ont été les premiers à observer en laboratoire une contraction musculaire dans le nerf sciatique d’une grenouille à la suite de la stimulation magnétique de ce nerf (Kolin et coll., 1959). Cette expérience constituait une preuve claire qu’un champ magnétique pouvait induire suffisamment de courant pour stimuler un nerf moteur.
Toutefois, ce n’est qu’en 1985 que le premier appareil de TMS moderne fût utilisé en clinique et en recherche. Cet appareil a été développé par le chercheur et physicien médical Anthony Barker et son équipe, à l’université de Sheffield en Angleterre. C’est cette équipe qui, la première, a documenté des mouvements de la main induits par la TMS et l’activité électrique qui y est associée (Barker et coll., 1985). L’équipe a reçu un prix d’innovation décerné par l’Institute of Electrical Engineers, en 1987, pour le développement de la TMS (Walsh et Pascual-Leone, 2003). Les premières investigations à l’aide de la TMS ont été conduites chez des personnes atteintes de sclérose en plaques ou de maladies des motoneurones et visaient à mesurer la vitesse de propagation de l’influx nerveux entre le cortex moteur et les muscles, à des fins diagnostiques (Horvath et coll., 2010). Le premier appareil de TMS comportait certaines limites. Le temps de charge était long et l’appareil tendait à surchauffer lorsque les impulsions magnétiques étaient rapprochées dans le temps (Noohi et Amirsalari, 2016). Avec l’engouement grandissant envers la TMS, plusieurs compagnies privées ont développé et mis sur le marché des appareils de TMS plus performants, permettant notamment d’utiliser des protocoles de TMS répétitive (un type de TMS où des impulsions ou des rafales d’impulsions sont appliquées à des intervalles de quelques secondes ou millisecondes ; Walsh et Pascual-Leone, 2003 ; Noohi et Amirsalari, 2016). Des bobines de différentes formes ont également été développées (voir figure 2), permettant de faire varier la résolution spatiale de la TMS (Georges et coll., 2007).

Figure 2. Exemple de deux types de bobines. A) Bobine en forme de huit. B) Bobine circulaire. Source : Magstim (2021)
En 1991, un des premiers articles scientifiques faisant état de l’utilisation de la TMS répétitive a été publié par Alvaro Pascual-Leone, aujourd’hui professeur en neurologie à la Harvard Medical School, et ses collègues. Dans cette étude, l’équipe de recherche avait observé que l’application de la TMS répétitive au niveau de régions de l’hémisphère gauche du cerveau pouvait interrompre la production de la parole (Horvath et coll., 2010). Quelques années plus tard, en 1995, Kolbinger et ses collègues, affiliés à des universités en Allemagne et Autriche, ont été parmi les premiers à publier les résultats d’une étude de type preuve de concept (c.-à-d., une étude visant à montrer la faisabilité d’une innovation) dans laquelle la TMS répétitive avait été utilisée chez des personnes ayant une dépression majeure réfractaire aux traitements pharmacologiques. Une réduction des symptômes avait alors été observée chez les participants et participantes de l’étude (Kolbinger et coll., 1995).
À la fin des années 1990, des équipes de recherche ont combiné l’utilisation de la TMS avec d’autres techniques de neuroimagerie comme l’imagerie par résonance magnétique (IRM) et la tomographie par émission de positrons (Horvath et coll., 2010). Ces recherches ont entre autres permis de constater que la TMS avait des effets directement sous la bobine, mais aussi des effets secondaires plus faibles dans des régions du cerveau connectées sur le plan anatomique (p. ex. Paus et coll., 1997).
Dès les débuts de l’utilisation de la TMS, plusieurs considérations éthiques ont été soulevées. Ces considérations étaient notamment liées à la sécurité des appareils de TMS, ainsi qu’aux effets secondaires ou à long terme potentiels (Horvath et coll., 2010). Ces considérations ont mené à la publication des premières lignes directrices de sécurité pour l’utilisation de la TMS en 1998 par Wassermann (Horvath et coll., 2010). Depuis ce temps, d’autres lignes directrices internationales de sécurité ont été publiées puis révisées afin de minimiser les risques associés à la TMS (Rossi et coll., 2009 et 2020). Ces lignes directrices sont rigoureusement suivies par les membres de notre laboratoire afin de rendre l’utilisation de la TMS sécuritaire. Tous les membres du laboratoire impliqués dans les études de stimulation sont en outre formés par la Dre Pascale Tremblay à l’utilisation sécuritaire de la TMS.
Au fil des années, la TMS s’est avérée être un outil de recherche important dans le domaine des neurosciences et de la psychiatrie pour mieux comprendre le fonctionnement du cerveau et de la moelle épinière chez des personnes en santé ou souffrant de troubles neurologiques ou psychiatriques. C’est un outil que nous utilisons au sein de notre laboratoire pour comprendre comment le cerveau nous permet de percevoir et produire la parole. Du côté de la pratique clinique, la TMS répétitive a été approuvée en 2002 par Santé Canada. Elle a aussi été approuvée par l’Agence américaine de surveillance des produits alimentaires et des médicaments (FDA) pour le traitement de la dépression réfractaire aux traitements pharmacologiques en 2008, des migraines en 2013, puis du trouble obsessionnel compulsif en 2018 (Horvath et coll., 2011 ; Stultz et coll., 2020). La TMS est utilisée comme outil thérapeutique en clinique, puisqu’elle peut induire des changements à moyen ou à long terme au niveau de l’excitabilité et de la connectivité de réseaux de neurones (Ziemann, 2017), un phénomène nommé « plasticité induite par l’expérience ».
Enfin, les avancées et connaissances scientifiques liées à la TMS se poursuivent toujours. Par exemple, pour mieux comprendre les mécanismes d’action de la TMS, son utilisation est de plus en plus combinée à celle de techniques de neuroimagerie comme l’électroencéphalographie, ou encore à celle de techniques de modélisation du courant, permettant de visualiser la distribution du champ électrique en fonction des sites de stimulation. La suite de l’histoire de la TMS reste donc à être écrite !
Autres lectures suggérées :
Références :
Barker A. T., Jalinous, R., & Freeston, I. L. (1985). Non-invasive magnetic stimulation of human motor cortex. Lancet, 1(8437):1106-7.
Faraday F. (1839). Experimental research in electricity. Volume 1. Taylor and Francis, London.
Geddes, L. A. (1999). Retrospectroscope. d’Arsonval, physician and inventor. IEEE Engineering in Medicine and Biology, 18(4), 118-122.
George, M. S., Bohning, D. E., Loberbaum, J. P., Nahas, Z., Anderson, B., Borckardt, J. J., … Belmaker, R. H. (2007). Overview of transcranial magnetic stimulation. In M. S. George, & R. H. Belmaker (Eds.), Transcranial magnetic stimulation in clinical psychiatry. Washington, DC: American Psychiatric Publishing, Inc.
Horvath, J. C., Perez, J. M., Forrow, L., Fregni, F., & Pascual-Leone, A. (2011). Transcranial magnetic stimulation: A historical evaluation and future prognosis of therapeutically relevant ethical concerns. Journal of Medical Ethics: Journal of the Institute of Medical Ethics, 37(3), 137–143.
Irving, M. R., & Chang, A. D. (2015). Introduction to brain stimulation. In Irving, M. R. (Ed.), Brain stimulation: Methodologies and Interventions. Hoboken, NJ: John Wiley & Sons, Inc.
Kolbinger, H. M., Höflich, G., Hufnagel, A., Müller, H.-J., & Kasper, S. (1995). Transcranial magnetic stimulation (TMS) in the treatment of major depression: A pilot study. Human Psychopharmacology: Clinical and Experimental, 10(4), 305–310.
Kolin, A., Brill, N. Q., & Broberg, P. J. (1956). Stimulation of irritable tissues by means of an alternating magnetic field. Proceedings of the Society for Experimental Biology and Medicine, 102:251–253.
Paus, T., Jech, R., Thompson, C. J., Comeau, R., Peters, T., & Evans, A. C. (1997). Transcranial magnetic stimulation during positron emission tomography: A new method for studying connectivity of the human cerebral cortex. The Journal of Neuroscience, 17(9), 3178–3184.
Rossi, S., Antal, A., Bestmann, S., Bikson, M., Brewer, C., Brockmöller, J. … Hallet, M. (2020). Safety and recommendations for TMS use in healthy subjects and patient populations, with updates on training, ethical and regulatory issues: Expert guidelines. Clinical Neurophysiology, 132(1):269-306.
Rossi, S., Hallett, M., Rossini, P. M., Pascual-Leone, A., & The Safety of TMS Consensus Group. (2009). Safety, ethical considerations, and application guidelines for the use of transcranial magnetic stimulation in clinical practice and research. Clinical Neurophysiology, 120(12), 2008–2039.
Stultz, D. J., Osburn, S., Burns, S., Pawlowska-Wajswol, S., & Walton, R. (2020). Transcranial magnetic stimulation (TMS) safety with respect to seizures: A literature review. Neuropsychiatric Disease and Treatment, 16:2989-3000.
Walsh, V., & Pascual-Leone, A. (2003). Transcranial Magnetic Stimulation: A Neurochronometrics of Mind. MIT press, Camridge, MA, 297 p.
Webster, K., & Ro, T. (2017). Retinal and visual cortex distance from transcranial magnetic stimulation of the vertex affects phosphene perception. Experimental Brain Research, 235(9), 2857–2866.
Ziemann, U. (2017). Thirty years of transcranial magnetic stimulation: where do we stand? Experimental Brain Research, 235(4), 973-984.



